細胞培養進口血清進口胎牛血清進口新生牛血清進口豬血清馬血清
細胞培養進口血清進口胎牛血清進口新生牛血清進口豬血清馬血清 支原體檢測盒及標準品常規PCR檢測試劑盒熒光定量PCR檢測(qPCR法)支原體DNA提取靈敏度標準品(方法驗證用)特異性標準品(方法驗證用)PCR定量標準品(可用于方法驗證)
支原體檢測盒及標準品常規PCR檢測試劑盒熒光定量PCR檢測(qPCR法)支原體DNA提取靈敏度標準品(方法驗證用)特異性標準品(方法驗證用)PCR定量標準品(可用于方法驗證) 支原體祛除試劑細胞中支原體祛除環境支原體祛除水槽支原體祛除
支原體祛除試劑細胞中支原體祛除環境支原體祛除水槽支原體祛除 干細胞培養基
干細胞培養基 DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監測
DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監測 RNA病毒研究試劑RNA病毒檢測試劑盒病毒RNA提取
RNA病毒研究試劑RNA病毒檢測試劑盒病毒RNA提取 PCR儀器及配套產品DNA污染監測祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預混液(凍干粉)熱啟動聚合酶MB Taq DNA
PCR儀器及配套產品DNA污染監測祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預混液(凍干粉)熱啟動聚合酶MB Taq DNA 微生物PCR檢測食品檢測類產品食品微生物檢測細菌PCR檢測
微生物PCR檢測食品檢測類產品食品微生物檢測細菌PCR檢測
- 細胞培養進口血清進口胎牛血清進口新生牛血清進口豬血清馬血清
- 支原體檢測盒及標準品常規PCR檢測試劑盒熒光定量PCR檢測(qPCR法)支原體DNA提取靈敏度標準品(方法驗證用)特異性標準品(方法驗證用)PCR定量標準品(可用于方法驗證)
- 支原體祛除試劑細胞中支原體祛除環境支原體祛除水槽支原體祛除
- 干細胞培養基
- DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監測
- RNA病毒研究試劑RNA病毒檢測試劑盒病毒RNA提取
- PCR儀器及配套產品DNA污染監測祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預混液(凍干粉)熱啟動聚合酶MB Taq DNA
- 微生物PCR檢測食品檢測類產品食品微生物檢測細菌PCR檢測
|
|
MB公司支原體產品常見問題和解答2020-09-03 13:32來源:威正翔禹|締一生物
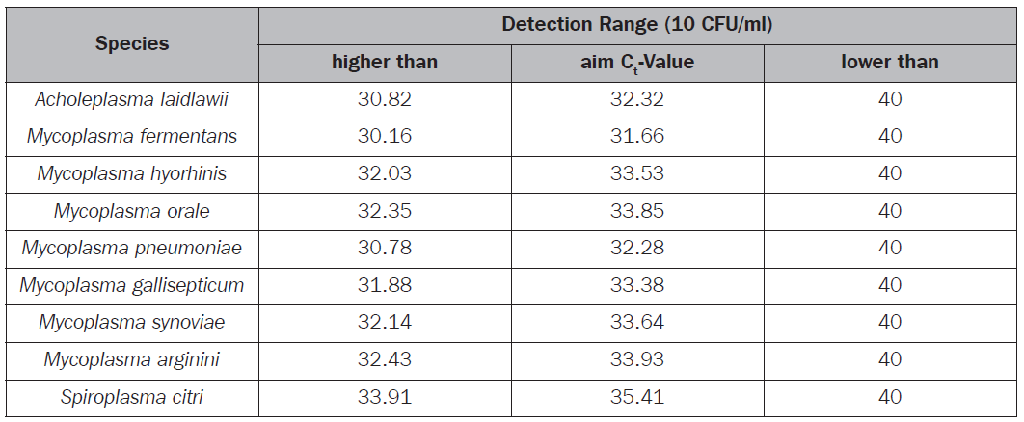
一支原體標準品部分 二支原體檢測部分 三其他 一、支原體標準品部分 問:標準品有什么資格認證證明嗎? MB廠家具有ISO 9001和ISO 13485體系認證。每個批次支原體標準品都有驗證和質控。同時支原體培養所用的培養基每個批次都依據EDQM(European Directorate for the Quality of Medicines)標準經過驗證和質控。標準品每一批的質控證書(COA)可從廠家網站上下載。支原體菌株來自英國NCTC菌種保藏中心,也有相應的ATCC編號。 10CFU標準品主要經過下列三方面的質控: 1. 功能檢測 即標準品復溶后作DNA抽提,再用專門合格的qPCR試劑盒檢測,應保證有擴增曲線。 2. 活力檢測 以保證標準品均已滅活。標準品在培養基中復溶并培養7天后,再進行DNA抽提和qPCR檢測,Ct值和對照比,應不超過允許閾值(ΔCt >2)。 3. 檢測閾限和批次合格標準 標準品用DMEM+5%FCS進行10倍梯度稀釋,形成3個稀釋度,DNA抽提后然后進行前后3輪qPCR檢測,每輪每個稀釋度重復8次。每種支原體的Ct平均值應達到如下標準,方為合格。
問:我們說的標準品就是質控菌的意思可以這么理解嗎? 質控菌株相當于藥典里的標準菌株。Minerva的所有標準品都是用于 qPCR或PCR驗證的,如果客戶是做別的用途,那就不適合了。 問:如何驗證滅活菌和活菌是一樣的? 因活支原體會造成實驗室污染(這對用戶來說是不可接受的),所以標準品采用的是滅活支原體。滅活支原體也是通過活支原體培養后再定量和滅活而來,它和活支原體的檢測是一樣的。最終檢測結果說明一切。 問:溶解標準品后,抽提是否全抽完,還是也可以保存 廠家建議10CFU標準品復溶了以后,要立即抽提,不要再保存,因為擔心可能降解。 問:您好,我這邊要提取10cfu對照品的基因組,10cfu對照品的說明書寫著用1ml基質重懸,基因提取試劑盒說一次上樣200μl進行提取,想問您一下,用200μl基質重懸10cfu可以嗎,想一次提完。 答:還是建議用1ml的基質重懸,因為靈敏度是以10CFU/ml為單位的。如果用200ul,濃度就高了。廠家建議10CFU標準品復溶了以后,要立即用完,不要再保存,擔心可能降解。 問:那1ml溶解的標準品,按提取試劑盒的要求,就得用多個管子一次提完對吧? 答:是的。 問:支原體10cfu標準品是干粉吧? 配完后是多少體積? 答:是凍干粉,加基質液后是1ML體積。 問:基質液產品里帶嗎? 答:這個產品里不帶,是客戶自己要檢測哪類樣品,就用樣品里的基質液(例如用的哪個培養基) 問:標準品用1ml溶解,就是用培養基? 是用樣本基質,要看客戶樣本是什么。如果是細胞上清,那就是用細胞培養基。要注意,溶解標準品的細胞培養基應沒有支原體污染。標準品同時帶陰性對照,陰性對照也是用培養基溶。 問:?支原體標準品一管可以用幾次? 答:1管可以用4次,廠家原文是actually you will get 4x 200 ul out of one vial. The kit consists of 3 vials. Replicates of 8 tests are usually required for a validation. So 2 tubes are needed and 1 is for safety. 問:10CFU標準品,驗證實驗中用量,即驗證實驗時需多少有效數據? 答:10CFU標準品,使用時需要用1ml你的樣本基質(如培養基)溶解,然后需要提取支原體DNA,以保證最高靈敏度(推薦MB公司的支原體DNA提取試劑盒)。每個DNA純化柱需要樣本量是200ul,產出是50ul。每個qPCR反應需要加DNA樣本量是10ul。MB廠家推薦1個樣本是8個復孔。一般靈敏度與耐用性(Robust)是在一起驗證的,也就是說,要前后做3輪獨立試驗,每次每個樣本建議是8個復孔,這樣計算下來,2管10CFU標準品是夠用了,這也正是10CFU標準品現在的包裝。說明:為保證結果可靠性,還需要同時做陰性對照。 問:qPCR法,是否需要分別用不同種類DNA定量標準品分別做標曲,來檢測同一個樣本,那引物探針是否是根據不同種類支原體而不同。 答:qPCR法,如要定量,先需確定是測定哪種支原體,再用該支原體DNA標準品做標曲。引物探針都是用的MB公司的同一mix,它可識別多種支原體物種。 問:一管DNA定量標準品稀釋后能用多久,如何保存。 答:一管DNA定量標準品稀釋后在-18℃以下保存。避免反復凍融。保存時間和標簽上的效期一樣。 問:支原體標準品和支原體DNA標準品有什么區別嗎? 答:德國MB公司提供的支原體10CFU標準品,用于PCR和qPCR檢測方法的靈敏度驗證。《歐洲藥典》第2.6.7章規定,用 PCR或qPCR方法對支原體進行檢測,其靈敏度需要達到10 CFU/ml。支原體基因組DNA是用于方法的特異性驗證。還有一種標準品叫PCR定量標準品,也是基因組DNA,它用于梯度稀釋,產生qPCR的標準曲線,具體請見網站相關頁面。 問:支原體標準品有濃度參數嗎? 答:MB的支原體標準品都是凍干粉,沒有濃度。 問:如果客戶購買10cfu標準品還需要提取基因組嗎,直接用95度煮行嗎? 答:按歐藥方法,需要用試劑盒提基因組。 問:10CFU靈敏度標準品提取DNA后,DNA量能有多少? 答:廠家回復如下:if there is no additional DNA in the sample matrix (e.c. eukaryotic cells), the amount of DNA after extraction is below 0.0001 ng! The mycoplasma genome is only about 1000000 bp and one cfu corresponds with 1 to 10 genome copies. 問:支原體10cfu標準品是干粉吧? 配完后是多少體積? 答:是凍干粉,加基質液后是1ML體積。 問:基質液產品里帶嗎? 答:這個產品里不帶,是客戶自己要檢測哪類樣品,就用樣品里的基質液(例如用的哪個培養基) 問:10cfu中陰性對照是什么?緩沖液? 答:陰性對照的制備,和支原體靈敏度標準品的制備一樣,但它不包含任何支原體顆粒。制備時陰性對照必須用同樣的樣品基質來溶解。具體是什么沒有提,應該這個是保密 問:特異性驗證用基因組DNA怎么溶解? 答:基因組DNA使用說明如下: 1.以**速度離心5秒鐘 2.將100 μl Tris緩沖液添加到DNA提取物中。 3.在室溫下孵育5分鐘。 4.短暫渦旋DNA并離心5秒鐘。 問:靈敏度標準品GU:CFU比值(支原體基因組/菌落數比值)是多少? 答:每一種和每批次支原體標準品的GU:CFU比值都不固定,具體見批次的COA。下表可以參考。
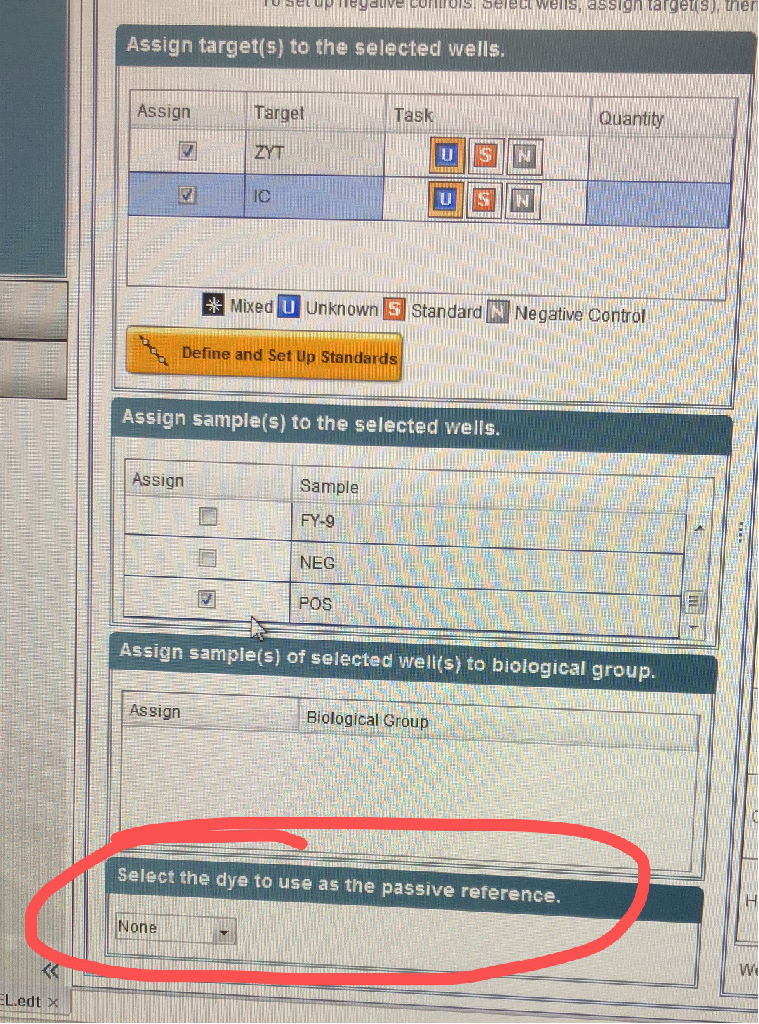
二檢測部分 問:提取試劑盒提DNA的回收率多少? 回收率依賴于DNA的類型(如GC含量,是基因組還是質粒)、操作者的技巧以及樣本基質的情況。因為這些情況,操作者很難達到生產商所給的回收率,從而形成各種討論,因此回收率沒寫到說明書里。但有一點可以很清楚,用該試劑盒從1ml只有10CFU支原體的樣品中提取DNA,這個濃度已經很低了,但用PCR或qPCR方法仍然能夠檢測出來,這從側面可以反映產率。廠家曾來信提到提取后的DNA的量在0.0001 ng以下! 支原體基因組約1000000 bp,1 cfu對應大約 1~10基因組拷貝。 問:提DNA是多少的體積洗脫,啥系統? 提DNA是用試劑盒中的緩沖液E 60μl洗脫。 整個提取方法,由四步組成:1)細胞裂解,2)DNA吸附到核酸純化柱上,3)去除殘留污染物和抑制劑,4)DNA洗脫。此方法無須酚/氯仿抽提,只需30分鐘即可完成制備,提供PCR所需的DNA。 問:?qEP的內控和陽性有具體值嗎? 這2個濃度廠家沒有提,因為不需要提。可以明確的是:結果陽性還是陰性,是看Ct值(Ct=40可看作是分界點)。至于qPCR標準曲線,是不能用qEP盒子里的陽性DNA來制備的。需要單獨購買PCR定量標準品,見http://13851990668.com/h-pd-210.html#_pp=0_516_328_-1 這里的標準品的量是明確的,每管是1×10的8次方copy 另廠家回復如下:We provide the concentration of the internal amplification control, but this DNA is artifical and not suitable for quantification. The positive control in the kit is not quantified precisely enough and due to the manufacturing process not accessibly in a quantitative form. Therefore, we offer the PCR Quantification Standards. 問:Ct閾值為啥是40,39或41可以嗎。是否有實驗依據? 廠家已回信,原文如下: the cut-off value is a result of the product validation, basically the evaluation of all runs performed for the sensitivity data 看上去是驗證后的閾值,是不可改變的。 問:陽性高,內控就低的原理是什么? 支原體DNA和內控DNA二者同時進行擴增,存在競爭性抑制。因此當樣本存在支原體污染時,由于內控對照與支原體DNA存在競爭,內控對照條帶變弱(例如支原體DNA>103拷貝)。相應的,在陽性對照中,內控對照條帶會完全消失。 問:DNA提取kit磁珠和純化柱區別大嗎.?別人的提取試劑盒提支原體DNA有什么注意事項? 據我們了解,磁珠法是通過磁珠包被有互補配體進行純化的。該方法的產率和核酸純度均會受到一些因素的影響,如磁珠與核酸結合的效率,以及樣本中的抑制劑。廠家回信說,DNA提取試劑盒的性能依賴于樣本基質的組成。某些樣品用磁珠法提取效果較好,一些其他樣品用離心柱的效果較好,沒有普遍的規律。關于別人的提取試劑盒提支原體dna有什么注意事項,我們對其他家的試劑盒不太了解,我們只負責MB的試劑盒。MB的支原體DNA抽提試劑盒對于支原體的DNA抽提,屬于離心柱法,經過廣泛測試,包括不同的樣本基質類型。發現即使10CFU的支原體,也可以提取DNA并被檢測到。 問:qEP和qonestep什么區別,能否替代 二者有2個區別,一是qEP的內控對照是獨立包裝,而 qOneStep的內控對照是在預混液內;二是qEP經過廠家方法驗證,廠家有驗證報告。qOneStep沒經過廠家方法驗證,沒有驗證報告。所以對于qEP可用于放行檢測,qOneStep只推薦用于支原體篩查,不能用于放行檢測。同時因為qOneStep加入的樣本量是2ul,而不是qEP的10ul, 這回給檢測閾值帶來5倍的影響。qOneStep靈敏度在說明書上沒有提,一個批次的COA上提到是50個基因組拷貝/反應。 需要說明的是,廠家的驗證只保證試劑盒符合藥典要求。但不能替代操作過程及樣本的適用性檢查。 問:廠家是做過與培養法做平行對照及驗證? 廠家做過qEP的方法驗證,同時也做了培養法的平行對照,它也是驗證報告的一部分。 問:在用qEP做支原體檢測的時候,加入內控對照品,在儀器設置上是需要選擇兩個通道嗎? 答:是需要2個通道,一個FAM, 問:我想問一下,7500儀器里面沒有HEX這個通道選項,可以用哪個通道代替呢? 答:7500這款是沒有HEX熒光標識,不過問過廠家,說7500有VIC,可以用VIC通道。 問:qPCR結果判定中,FAM positive,HEX irrelevant中這個不相關是具體指什么? 答:這個不相關是指如果FAM是陽性,那么由于擴增時存在競爭性抑制,所以內控是否有擴增,其無關緊要。二者存在競爭性,是因為酶和dNTP對于二者的擴增都是需要的,這將決定新合成的DNA的量各自有多少。 問:在用樣品制備試劑盒時,進行支原體DNA提取時,加入內控對照品,實際上是監控在提取操作總是否能夠binding支原體DNA,而無法監測這步操作的回收率的,是嗎? 答:“實際上是監控在提取操作總是否能夠binding支原體DNA”,可以這么理解,或者說是在監測整個提取過程。我們又問了一下廠家,內控和樣品的提取效率是一樣的,這樣可以反映樣品的真實情況,因為只要內控提取后能測出來,那就表明提取是沒有問題的。極少量的支原體如10CFU的,通過提取,也是可以檢測到的,表明靈敏度是沒有問題的。樣本Ct值和10CFU的Ct值比較,是可以進行相對定量的。 問:你們好,我問一下你們這個Venor Gem qEP試劑盒能做放行檢測嗎? 答:放行應相當于國外說的release testing, 問:這個如果是用來檢測細胞上清,是不是就不用提取DNA了呢? 答:只要是跟藥典有關,跟臨床治療或制藥檢驗有關,就需要提取DNA。如果僅僅是科研用培養細胞,篩查支原體,則可以不提。 問:詢問qPCR儀器的設置 答:具體可見MB廠家文件Venor?GeM qEP: Cyclers Programming,可從網站上下載。 問:被動參比染料是選“none”吧?
答:對,沒有ROX,選none 問:大家好,想咨詢一下,咱們支原體DNA提取時所取的樣本量是依據什么定的呢,比如,我們有CAR-T細胞,病毒液等,如果CAR-T細胞按細胞數來的話取多少細胞數比較好,或者如果病毒液按體積的話多少體積更佳呢? 答:支原體 問:病毒液就是類似細胞上清的。如果體積大于200ul的話我們可以濃縮,但是這個體積有沒有一個上限呢? 答:體積有上限,是200 to 1000 μl, 問:這個抽提試劑盒的收率有多少,是磁珠還是吸附柱?吸附柱的收率**能有,因為以前我們用其他品牌的抽提試劑盒,收率只有百分之六,這樣的話,就存在假陰性結果的可能。 答:是吸附柱的方法。提取試劑盒的COA里,用的是很少量的支原體10CFU/ml,提取DNA后都可以檢測到。廠家來信說,產率依賴于DNA的類型(如GC含量,是基因組還是質粒)、操作者的技巧以及樣本基質的情況。因為這些情況,操作者很難達到生產商所給的比率,從而形成各種討論,因此產率沒寫到說明書里。 問:要檢測支原體的培養基中有酚紅,是否還需要抽提? 答:只要是在25ulPCR體系中加入的樣本量≤2ul,酚紅就不會對qPCR構成問題。更高濃度的酚紅會引起基線偏移,造成靈敏度降低。如果僅僅是篩查,則不需要抽提DNA。如果是做10CFU/ml的產品放行檢查,則需要抽提了。細胞基質的驗證總是要做的。 問:做qPCR,一個陰性對照Ct約為40,也有擴增曲線。是什么原因? 答:Ct值大于40可能是由于產生非特異性信號(如primer artefacts)以及極微小的污染所致。 但是,該結果是不具有可重復性的,因此結果仍然是陰性。 問:一步法的盒子的靈敏度是否總低于經典法試劑盒?有沒有可能一步法的盒子也能檢測10CFU? 答:廠家回復如下:意思是一步法的樣本量為2ul用于支原體篩查,經典法為10ul,用于產品的放行檢測。檢測10CFU的標準品非常具有挑戰性。一步法因為樣本量不夠,很難達到10CFU/ml。如果客戶想要包含DNA聚合酶的PCR試劑盒,可以選擇VenorGeM Classic G型試劑盒。它和經典法(不含酶)的交叉驗證確實做過,顯示同樣的靈敏度。但全套的驗證沒有做過。 問:PCR經典法,跑膠時體現1條陽性帶,是否代表PCR經典法可以檢測多種支原體,無法區分支原體種類? 答:PCR經典法,跑膠時為1條陽性帶,無法區分支原體種類,需要將擴增產物測序鑒定。 問:qEP的陽性對照一個25次的盒子里大概可以做幾次? 答:這個陽性對照是綠蓋管,復溶是加300ul水。如果是科研,每次用2ul。制藥是每次用10ul,這樣分別是做150次和30次。但是大包裝的qEP的陽性對照仍然只是1管或2管。 問:如何設置閾值線? 答:設置閾值的一種好方法是將其置于陽性對照擴增曲線的線性區域的中間(如果以對數坐標顯示)。 問:內控對照的曲線和樣品擴增曲線是否共享同一閾值線? 回答:是的。 問:是否每次做支原體DNA抽提時都要設陰性對照? 答:不需要。只有靈敏度標準品抽提時才需要設陰性對照,以避免外源干擾。 問:一藥廠關于細胞發酵液,檢支原體的問題 1000升反應器,有血清培養,抗體藥,想用qpcr檢支原體,更利于大規模樣品的自動檢測。原有用過羅氏和AVI的qPCR檢測盒子,都發生過抑制pcr現象,所以,想找廠家了解: ①Minerva的qPCR盒子,是否經常碰到抑制的現象,怎樣規避? ②是否可以找廠家要小規模樣品試試 ③關于藥廠類的客戶,方法學驗證上有什么資料嗎?希望能看看檢測報告?檢測敏感度希望做到<10CFU。 答:①細胞培養基隨著時間的延長,可能積聚抑制 PCR 的物質。已知血清含量大于 12%的培養基對下游操作(例如 PCR)有抑制作用。而且,培養基中的酚紅,對 qPCR 的熒光檢測也有交叉作用,產生假陽性。這些弊端可通過支原體 DNA 提取試劑盒(Minerva廠家有提供)提取樣本DNA來克服。 ②目前有qPCR一步法的樣品試劑盒。如客戶需要qPCR檢測方法符合歐洲藥典,可則選用qEP試劑盒(也是qPCR方法),該樣品廠家應可以提供。如不需要符合歐洲藥典,qPCR一步法的樣品試劑盒就可以。但在使用之前,務必要做樣品中的DNA提取,以規避樣品中抑制PCR反應的物質。 ③關于藥廠類的客戶,方法學上有驗證。qEP試劑盒有驗證資料,可以提供,但為內部參考,請不要外傳。qEP靈敏度可以達到10CFU及以下。Minerva廠家也提供有10CFU支原體標準品(包括套裝或單種支原體)可以驗證檢測的靈敏度。 支原體 DNA 提取試劑盒目前我們無樣品,可能廠家有樣品,待聯系。 其提取方法容易操作,分為四步:1)細胞裂解,2)DNA 吸附到核酸純化柱上,3)去除殘留污染物和抑制劑,4)DNA 洗脫。此方法無須酚/氯仿抽提,只需 30 分鐘即可完成制備。 以下附上產品中文說明書以及qEP驗證報告。 問:一步法的盒子的靈敏度是否總低于經典法試劑盒?有沒有可能一步法的盒子也能檢測10CFU? 答:一步法的樣本量為2ul,經典法為10ul(工業樣本)。檢測10CFU的標準品非常具有挑戰性。一步法因為樣本量不夠,很難達到10CFU/ml。如果客戶想要包含DNA聚合酶的PCR試劑盒,可以選擇VenorGeM Classic G型試劑盒。 一步法和經典法的交叉驗證確實做過,顯示同樣的靈敏度。但其他驗證沒測過。 原文如下: The product VenorGeM OneStep works with 2 ul sample volume and is designed for screening. VenorGeM Classic works with 10 ul sample volume max. and was designed for sensitive product release testing. As the detection limit of 10 CFU/ml is is extremly challenging, VenorGeM OneStep will not be able to provide such sensitivity due to the lack of sample volume. If the customer wants to get the benefit of included polymerase, the VenorGeM Classic G-Version might be an option. Anyhow, we do only have a cross-validation in place and not a full-product validation, showing equal sensitivities for one mycoplasma species. 問:一種支原體的存在會干擾另一種支原體的DNA定量嗎? 三 其他 問:關于zellshield 客戶是自己配干粉培養基,過濾孔徑0.22um。過濾前加還是過濾后加,會不會把zellshield有效成分濾掉?轉染質粒和包病毒會不會有影響?雙抗對有的轉染試劑有些影響我們的zellshield呢? Zellshield可以先加到培養基中,再過濾。Zellshield不影響質粒轉染或病毒包被。但請注意,支原體在Zellshield作用下會抑制生長。支原體會干擾質粒轉染或病毒包被。 問:Mynox與Mynox Gold區別? 答:Mynox Gold是套裝,包括1管**治療液和3管鞏固防護液。**治療液主要為Mynox,但它的濃度要比單純的Mynox產品濃度要低,它對細胞毒性可忽略不計,鞏固防護液主要為復合抗生素成分。Mynox Gold對細胞更溫和,更適合原代細胞或嬌貴的細胞,但需要細胞傳四代才能完成所有治療,需要時間較長。但它不適用于病毒液中的支原體清除。 Mynox產品是只作用1次,用1管,它適用于病毒液中的支原體清除。也適用細胞系等較好養細胞中的支原體清除。它對細胞有一定毒性,使用時需要經常觀察。細胞可能存在一定損失,這會通過細胞的增殖予以彌補。如果Mynox的細胞毒效應比較明顯,應立即換液以終止治療。如果細胞對Mynox比較敏感,治療時間可縮短,貼壁細胞可縮短至半小時,懸浮細胞縮短至15分鐘。 要注意,Mynox是通過與支原體接觸才發揮作用的,使用時要將細胞打散,不能成團,否則支原體藏在細胞團的間隙中,影響Mynox與支原體的結合。同時要注意FCS的濃度不能高于5%。對于病毒懸液,需先離心1000rpm,5分鐘去除細胞碎片,再進行Mynox對支原體的清除,否則細胞碎片會產生競爭性結合。 上一篇: 高品質新生牛血清在生產過程中就嚴格把控
|
 細胞培養進口血清
細胞培養進口血清 支原體祛除試劑
支原體祛除試劑 干細胞培養基
干細胞培養基