細胞培養進口血清進口胎牛血清進口新生牛血清進口豬血清馬血清
細胞培養進口血清進口胎牛血清進口新生牛血清進口豬血清馬血清 支原體檢測盒及標準品常規PCR檢測試劑盒熒光定量PCR檢測(qPCR法)支原體DNA提取靈敏度標準品(方法驗證用)特異性標準品(方法驗證用)PCR定量標準品(可用于方法驗證)
支原體檢測盒及標準品常規PCR檢測試劑盒熒光定量PCR檢測(qPCR法)支原體DNA提取靈敏度標準品(方法驗證用)特異性標準品(方法驗證用)PCR定量標準品(可用于方法驗證) 支原體祛除試劑細胞中支原體祛除環境支原體祛除水槽支原體祛除
支原體祛除試劑細胞中支原體祛除環境支原體祛除水槽支原體祛除 干細胞培養基
干細胞培養基 DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監測
DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監測 RNA病毒研究試劑RNA病毒檢測試劑盒病毒RNA提取
RNA病毒研究試劑RNA病毒檢測試劑盒病毒RNA提取 PCR儀器及配套產品DNA污染監測祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預混液(凍干粉)熱啟動聚合酶MB Taq DNA
PCR儀器及配套產品DNA污染監測祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預混液(凍干粉)熱啟動聚合酶MB Taq DNA 微生物PCR檢測食品檢測類產品食品微生物檢測細菌PCR檢測
微生物PCR檢測食品檢測類產品食品微生物檢測細菌PCR檢測
- 細胞培養進口血清進口胎牛血清進口新生牛血清進口豬血清馬血清
- 支原體檢測盒及標準品常規PCR檢測試劑盒熒光定量PCR檢測(qPCR法)支原體DNA提取靈敏度標準品(方法驗證用)特異性標準品(方法驗證用)PCR定量標準品(可用于方法驗證)
- 支原體祛除試劑細胞中支原體祛除環境支原體祛除水槽支原體祛除
- 干細胞培養基
- DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監測
- RNA病毒研究試劑RNA病毒檢測試劑盒病毒RNA提取
- PCR儀器及配套產品DNA污染監測祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預混液(凍干粉)熱啟動聚合酶MB Taq DNA
- 微生物PCR檢測食品檢測類產品食品微生物檢測細菌PCR檢測
|
|
【2018年全國藥品微生物檢驗控制技術精要培訓班會議】在寧波拉開帷幕!2018-11-29 09:02來源:締一生物
《中國藥典》2020年版相關微生物增修訂內容陸續公示,國家關于藥品微生物控制技術指南相繼出臺。 為把握標準動態,提升技術水平,應對當前藥品微生物檢驗控制的迫切需求,11月28-30日,2018年全國藥品微生物檢驗技術精要培訓班在浙江省寧波市拉開帷幕。
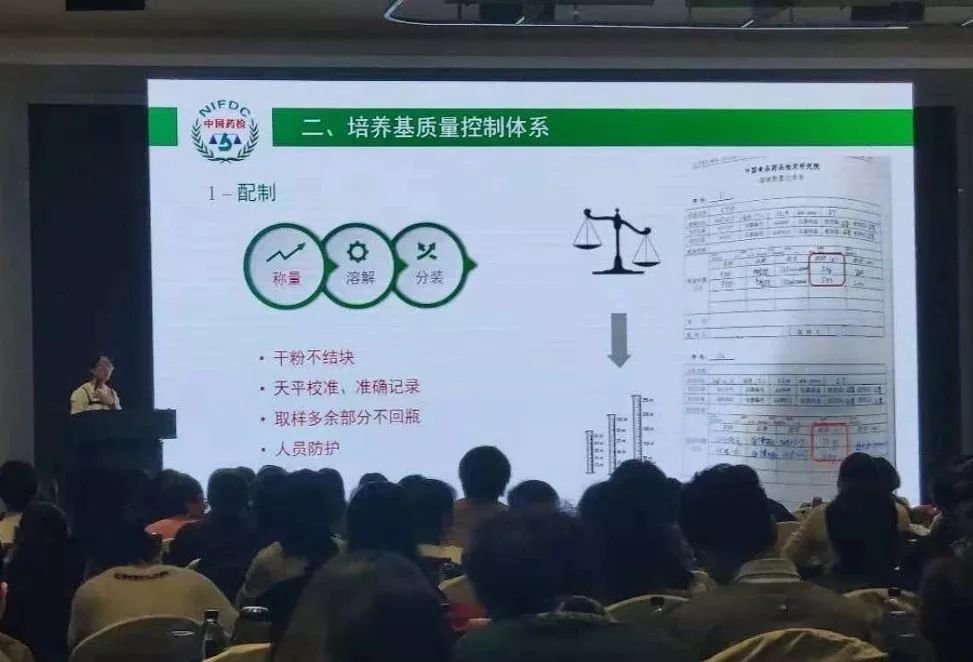
今天上午,中國食品藥品檢定研究院化藥所首席專家吳昌勤講述了“我國藥品微生物檢驗控制現狀與發展”。他首先回顧了歷年中國藥典的修訂和主要變化。 例如: 2015年版中國藥典,在檢驗理念上,已經從簡單的終產品檢驗,向風險調查、風險評估、風險管理方向轉變;并且促使藥企的微生物實驗室,在對樣品的前處理、實驗過程控制、污染菌的鑒定和溯源分析等方面形成SOP,進而促進藥品微生物檢驗能力的提升。
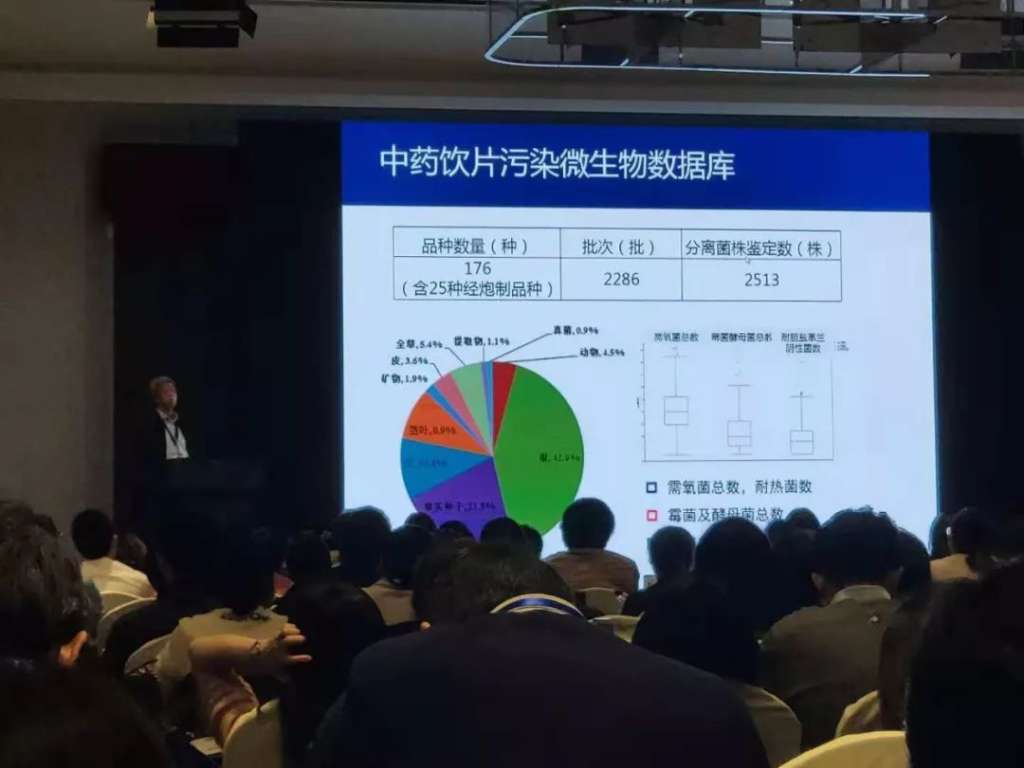
在中國藥典2020年版的修訂方面,他提到化學藥品將以注射劑再評價為契機,深入探討注射劑生產過程中無菌保障體系的評估與調查策略,促使企業成為控制微生物污染的主體,其目標是使化學藥品全面與國際接軌。 中藥是我國的特色。藥典制定委員會將在已建立的中藥飲片污染微生物數據庫的基礎上,以中藥飲片微生物限度標準的制定為突破口,基于風險控制理念,探討不同用途中藥控制微生物污染的策略與方法,使中藥標準符合藥材生產和應用的特點。
緊接著,中國食品藥品檢定研究院化藥所微生物室副主任馬仕洪,報告了當前幾起藥品微生物事件引起的反思,以及不可接受微生物的概念。 他首先從一例化學藥微生物污染事件講起。有一例介入治療的患者出現腔道感染和菌血癥。經調查,污染源是來自凝膠劑中的洋蔥伯克霍爾德菌。這個不應該出現的嚴重藥品微生物事件,不僅警示我們藥品的微生物標準仍需完善,也提出對于不可接受微生物,應引起重視和加強檢查。
不可接受微生物是指那些已知有明顯致病性,存在足夠數量,通過產品的給藥途徑可能導致患者不可接受風險的微生物。《中國藥典-四部通則107》“非無菌藥品微生物限度標準”規定,對于原料輔料以及某些特定的制劑,應根據其特性和生產工藝,可能還需檢查其他具有潛在危害的微生物。 |
 |
 細胞培養進口血清
細胞培養進口血清 支原體祛除試劑
支原體祛除試劑 干細胞培養基
干細胞培養基