細胞培養進口血清進口胎牛血清進口新生牛血清進口豬血清馬血清
細胞培養進口血清進口胎牛血清進口新生牛血清進口豬血清馬血清 支原體檢測盒及標準品常規PCR檢測試劑盒熒光定量PCR檢測(qPCR法)支原體DNA提取靈敏度標準品(方法驗證用)特異性標準品(方法驗證用)PCR定量標準品(可用于方法驗證)
支原體檢測盒及標準品常規PCR檢測試劑盒熒光定量PCR檢測(qPCR法)支原體DNA提取靈敏度標準品(方法驗證用)特異性標準品(方法驗證用)PCR定量標準品(可用于方法驗證) 支原體祛除試劑細胞中支原體祛除環境支原體祛除水槽支原體祛除
支原體祛除試劑細胞中支原體祛除環境支原體祛除水槽支原體祛除 干細胞培養基
干細胞培養基 DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監測
DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監測 RNA病毒研究試劑RNA病毒檢測試劑盒病毒RNA提取
RNA病毒研究試劑RNA病毒檢測試劑盒病毒RNA提取 PCR儀器及配套產品DNA污染監測祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預混液(凍干粉)熱啟動聚合酶MB Taq DNA
PCR儀器及配套產品DNA污染監測祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預混液(凍干粉)熱啟動聚合酶MB Taq DNA 微生物PCR檢測食品檢測類產品食品微生物檢測細菌PCR檢測
微生物PCR檢測食品檢測類產品食品微生物檢測細菌PCR檢測
- 細胞培養進口血清進口胎牛血清進口新生牛血清進口豬血清馬血清
- 支原體檢測盒及標準品常規PCR檢測試劑盒熒光定量PCR檢測(qPCR法)支原體DNA提取靈敏度標準品(方法驗證用)特異性標準品(方法驗證用)PCR定量標準品(可用于方法驗證)
- 支原體祛除試劑細胞中支原體祛除環境支原體祛除水槽支原體祛除
- 干細胞培養基
- DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監測
- RNA病毒研究試劑RNA病毒檢測試劑盒病毒RNA提取
- PCR儀器及配套產品DNA污染監測祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預混液(凍干粉)熱啟動聚合酶MB Taq DNA
- 微生物PCR檢測食品檢測類產品食品微生物檢測細菌PCR檢測
|
|
鑒別大腸桿菌,HiCrome優于傳統的EMB瓊脂2018-09-14 10:19來源:締一生物
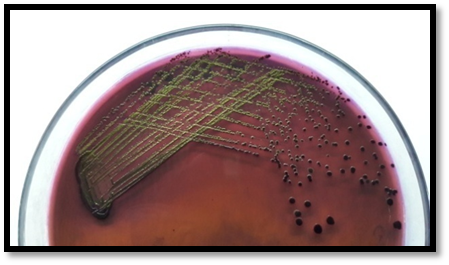
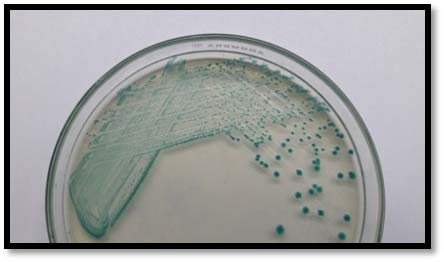
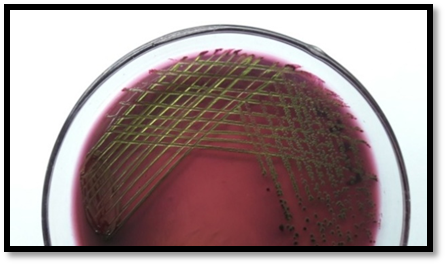
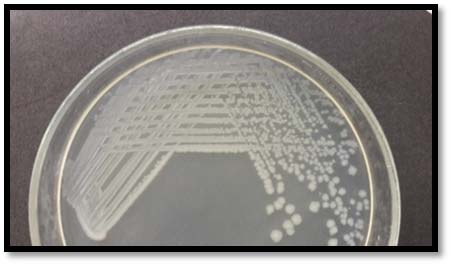
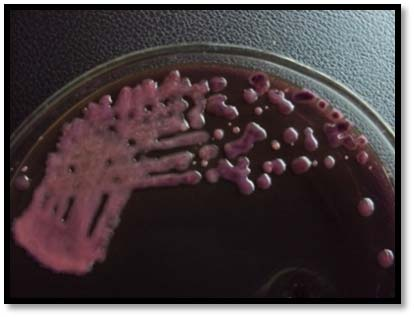
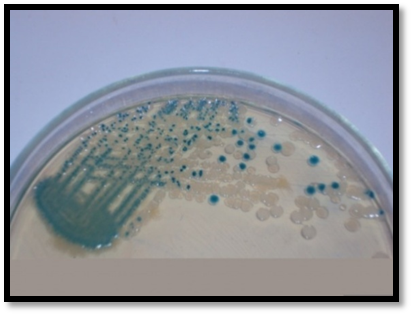
以下內容出自專業期刊上2016年發表的一項研究,具有代表性。具體如下: 原題目(翻譯):EMB瓊脂和HiCrome大腸桿菌瓊脂對都產生綠色金屬光澤的非大腸桿菌與典型大腸桿菌鑒別能力的比較評估 原題目:Comparative Evaluation of EMB Agar and Hicrome E. coli Agar for Differentiation of Green Metallic Sheen Producing Non E. coli and Typical E. coli Colonies from Food and Environmental Samples 出處:Journal of Pure and Applied Microbiology. 2016,10(4) 糞大腸菌群或大腸桿菌的濃度常決定了食品和水的衛生質量。為了保障公共安全,娛樂用水、飲用水源和養殖用水常需嚴格監測。為實現這些評估要求,大腸桿菌的分離和鑒定是必要的先決條件,但實踐中遇到的情況千變萬化,因為存在其他的腸道干擾菌如檸檬酸菌屬、克雷伯菌屬和腸桿菌屬。它們也發酵乳糖,并且在EMB瓊脂(伊紅美蘭瓊脂,常用于腸桿菌科成員的分離計數鑒別)上表現為相似的菌落特征。這些大腸菌群與糞大腸菌群不同,也存在于其他環境中,它們的存在并不指示有糞便污染。實際上常用BGLB肉湯和更高的孵育溫度(44.5℃)區分這些競爭菌群,但并不總能如此,因為它們也常常表現為相似的反應。 特別是當這些競爭菌群數量都較多時,問題更為突出,結果使假陽性數量增多,降低了選擇培養基的效率。但很少有人提出解決方案。目前有很多報道使用顯色培養基分離腸出血性大腸桿菌O157:H7,但關于其他血清型的大腸桿菌的分離鑒別則很少。因此,應嘗試采用更新的培養基和方法來快速、準確的分離這種指示菌,從而有助于避免錯誤的解讀。 本文比較了一種顯色培養基HiCrome E.coli瓊脂(HiMedia,印度)和EMB瓊脂在分離不同來源大腸桿菌的性能(HiMedia,印度)。相伴隨的干擾菌群也進行了鑒定,并且與大腸桿菌進行了系統發生學上的比較。 材料與方法 細菌培養和標準菌株 本研究納入了400株疑似大腸桿菌的分離株,它們來自不同樣本:活蛤蜊(n = 140)、市場上的雙殼貝類肉(n = 45)、水(n=100)和熱帶沉積物河口(n = 100)和飲用水(n=15)。 大腸桿菌ATCC 25922和4個其他菌株GenBank號為JX183939.1、JX183940.1、JX183941.1和JX183942作為標準參照菌株。 取樣、分離和生化分析 按照標準指南進行樣本無菌收集和處理(見注1)。大約25克貝類肉無菌轉移到無菌的勻漿袋中,并在一個勻漿袋(IUL Instruments,西班牙)中與225毫升無菌蛋白胨水混合。使用5管含乳糖的肉湯對大腸桿菌分離株進行MPN檢測。 同樣,沉積物和水樣也進行稀釋(1:9比例),并按同樣方法檢查大腸桿菌的存在。在44.5°C溫育24-48小時進行乳糖發酵的檢測。從顯示生長和產氣的管中取樣,用接種環在常規Levine's Eosin-methylene blue瓊脂(L-EMB,Himedia,印度)或Hicrome大腸桿菌瓊脂上劃線。在37℃孵育24小時后觀察平板。關于EMB,像大腸桿菌這樣強烈產酸的菌落有綠色金屬光澤,并顯示中心黑色。在酸性條件下,染料伊紅Y發生沉淀,產生黑色菌落。綠色金屬光澤是由于伊紅Y和亞甲基藍之間形成酰胺鍵。另一方面,Hicrome大腸桿菌瓊脂檢測大腸桿菌是基于葡糖醛酸糖苷酶的存在。培養基中的顯色底物p-硝基苯-p-D-吡喃葡萄糖醛酸(PNPG)被大腸桿菌吸收。大多數大腸桿菌(O157:H7除外)含有β-葡糖醛酸酶,能裂解顯色底物發色團與葡萄糖醛酸苷之間的化學鍵,釋放前者,產生藍綠色菌落。在測試樣品之前,使用五種標準菌株,在控制條件下,對兩種培養基的有效率進行了評估。EMB瓊脂和Hicrome大腸桿菌瓊脂都是100%。典型菌落采用IMViC試驗進行了生化鑒定,包括吲哚產生試驗,甲基紅試驗,伏普試驗和檸檬酸鹽利用試驗。 檢測uid A基因進行分子驗證(略) 大腸桿菌的血清分型(略) 16S rRNA擴增測序(略) 系譜發生分析(略) 統計學分析 %靈敏度 = 真陽性 x 100 / (真陽性+ 假陰性) %特異性 = 真陰性 x 100 / (真陰性+假陽性) % 有效率 = (真陽性 + 真陰性) x100 / 全部 結果和討論 EMB瓊脂和Hicrome大腸桿菌瓊脂在五種標準菌株的識別中顯示出100%的有效率(數據未提供)。然而,在天然樣品中,當都產生金屬光澤的非大腸桿菌和真正的大腸桿菌都存在時,問題就來了。兩種培養基分離鑒定大腸桿菌的結果見表1和表2。在EMB瓊脂上假陽性率非常高(40%),而在Hicrome上則非常低(0.5%)。 假陰性在EMB瓊脂上也很高(15.75%),這是由于真正的大腸桿菌被高度粘液狀背景菌群所掩蓋,而在Hicrome大腸桿菌瓊脂上,沒有檢測到假陰性(表1)。同時,Hicrome的靈敏度、特異性和有效率遠遠高于Levine’s EMB瓊脂(表2)。 大腸桿菌和非大腸桿菌在HiCrome大腸桿菌瓊脂和EMB瓊脂上的生長狀況 真正的大腸桿菌在EMB瓊脂上產生非常亮的金屬光澤菌落,在Hicrome大腸桿菌瓊脂產生藍綠色菌落(圖1)。相反,在EMB上大量典型的具有亮金屬光澤的大腸桿菌疑似菌落,在Hicrome大腸桿菌瓊脂上為白色菌落。生化鑒定顯示,它們不是大腸桿菌(圖2)。實驗還觀察到,如果樣品中大腸桿菌的濃度較低,其光澤就會被高粘液狀背景菌群如克雷伯氏菌所掩蓋(圖3),導致假陰性結果,它可以通過使用Hicrome大腸桿菌瓊脂進行有效區分。
圖1a. EMB瓊脂上產生亮金屬光澤的大腸桿菌菌落
圖1b. HiCrome E. coli agar上的藍綠色大腸桿菌菌落
圖2a. EMB瓊脂上產生亮金屬光澤的假陽性的非大腸桿菌菌落
圖2b. 相應菌落在HiCrome E. coli agar的形態顏色
圖3a. EMB瓊脂上的干擾菌落
圖3b.相應菌落在HiCrome E. coli agar上。藍綠色真正大腸桿菌的菌落與白色菌落的干擾菌群可以清楚的區分
表1
表2 分離株的生化特征 EMB瓊脂上的亮金屬光澤菌株顯示出6種不同的IMViC反應(表3)。前兩種反應為真正的大腸桿菌,其他反應為非大腸桿菌。
表3 分離株的分子驗證 所有生化證實為大腸桿菌的菌株,其uid A基因均為陽性,其余四組生化反應對應的菌株uid A基因擴增陰性 16s rRNA擴增和測序 前2個生化反應對應的菌株再次驗證為大腸桿菌。后面四組類型的非大腸桿菌鑒定為阿斯腸桿菌(E19), 佐治亞克呂沃爾菌(E3), 成團泛生菌(E 30) 和固氮植物菌(Phytobacter diazotrophicus) (2ss1B3),全都屬于腸桿菌科成員。 系譜發生分析(略) 大腸桿菌的血清分型 分離株發現有20個血清型,包括腸出血性O157:H7(3.5%),產腸毒素O8(8%),產志賀毒素O121(4.5%),腸侵襲性O124(0.5%)和腸致病性O91(0.5%)血清型。從HiCrome大腸桿菌瓊脂分離出2-D-葡萄糖醛酸酶陽性非典型大腸桿菌O157:H7菌株,它本來會被忽略,因為培養基只檢測葡萄糖醛酸酶陰性的典型分離株(注2)。 其他血清型包括O2,O4,O9,O17,O27,O33,O34,O35,O84,O118,O119,O120,O126,O141和O156。 該研究證明了Hicrome大腸桿菌瓊脂(99.5%)對EMB瓊脂(44.25%)的診斷效率。同樣,Hicrome大腸桿菌瓊脂靈敏度和的特異性也很遠高于EMB瓊脂(表2)。增加EMB瓊脂的假陽性率,使得分離這個簡單的有機體十分繁瑣,需要挑取太多的菌落,最終在遺失真正陽性菌落的同時,只發現出很少的陽性菌落或根本沒有陽性菌落(圖2和圖3)。 經常觀察到從EMB瓊脂中分離出來大腸桿菌,與其他菌群具有很強的關聯,其生長逐漸會超過大腸桿菌,而導致最初要分離菌株的逐漸減少。這種現象可以通過使用顯色培養基來克服或大大減少。大部分的從EMB中分離出的假陽性屬于腸桿菌科,它提示EMB瓊脂從其他表型特征近似的腸桿菌科中鑒別出大腸桿菌的效率較低。以前有報道稱檸檬酸桿菌屬,腸桿菌屬,傷口埃希氏菌,棲冷克呂沃爾氏菌、哈夫尼菌屬、克雷伯菌屬、拉恩氏菌屬和沙雷菌屬在EMB瓊脂上也形成大腸桿菌樣的的假陽性菌落。但據我們所知,這是**份報告阿斯腸桿菌,佐治亞克呂沃爾菌和固氮植物菌(Phytobacter diazotrophicus)在EMB瓊脂上形成假陽性菌落。 結論 盡管Hicrome大腸桿菌瓊脂比EMB瓊脂價格更高,但當所有因素都考慮時,顯色培養基則是更有效、更快速和經濟的方法,可以節省時間和錢。 簡而言之,這種培養基是強力推薦用于菌落數量較多的樣品,因為它的準確度和簡單性,即使經驗不足的實驗室人員也可以確定其鑒定結果,而無須再進一步的確證性生化或分子檢測。 注1. American Public Health Association: Recommended Procedures for the Examination of Seawater and Shellfish, 4th ed. APHA, Washington, DC, 1970. American Public Health Association: Compendium of Methods for the Microbiological Examination of Foods, 3rd ed.APHA, Washington, DC, 1992. Bacteriological Analytical Manual: Chapter 4, Enumeration of Escherichia coli and the Coliform Bacteria, 2002. http://www.fda.gov/Food/FoodScienceResearch/LaboratoryMethods/ucm064948.htm 注2. Manafi, M., Kremsmaier, B. Comparative evaluation of different chromogenic/fluorogenic media for detecting Escherichia coli O157:H7 in food. Int. J. Food Microbiol., 2001; 71: 257–262
|
 細胞培養進口血清
細胞培養進口血清 支原體祛除試劑
支原體祛除試劑 干細胞培養基
干細胞培養基